Full validation of curcumin analytical method by LC-MS/MS points out that the degree of hemolysis in plasma affects the quantitation: application in dog plasma study
DOI:
https://doi.org/10.29356/jmcs.v62i4.662Keywords:
Curcumin, hemolysis, LC MS/MS, SRM, dog plasmaAbstract
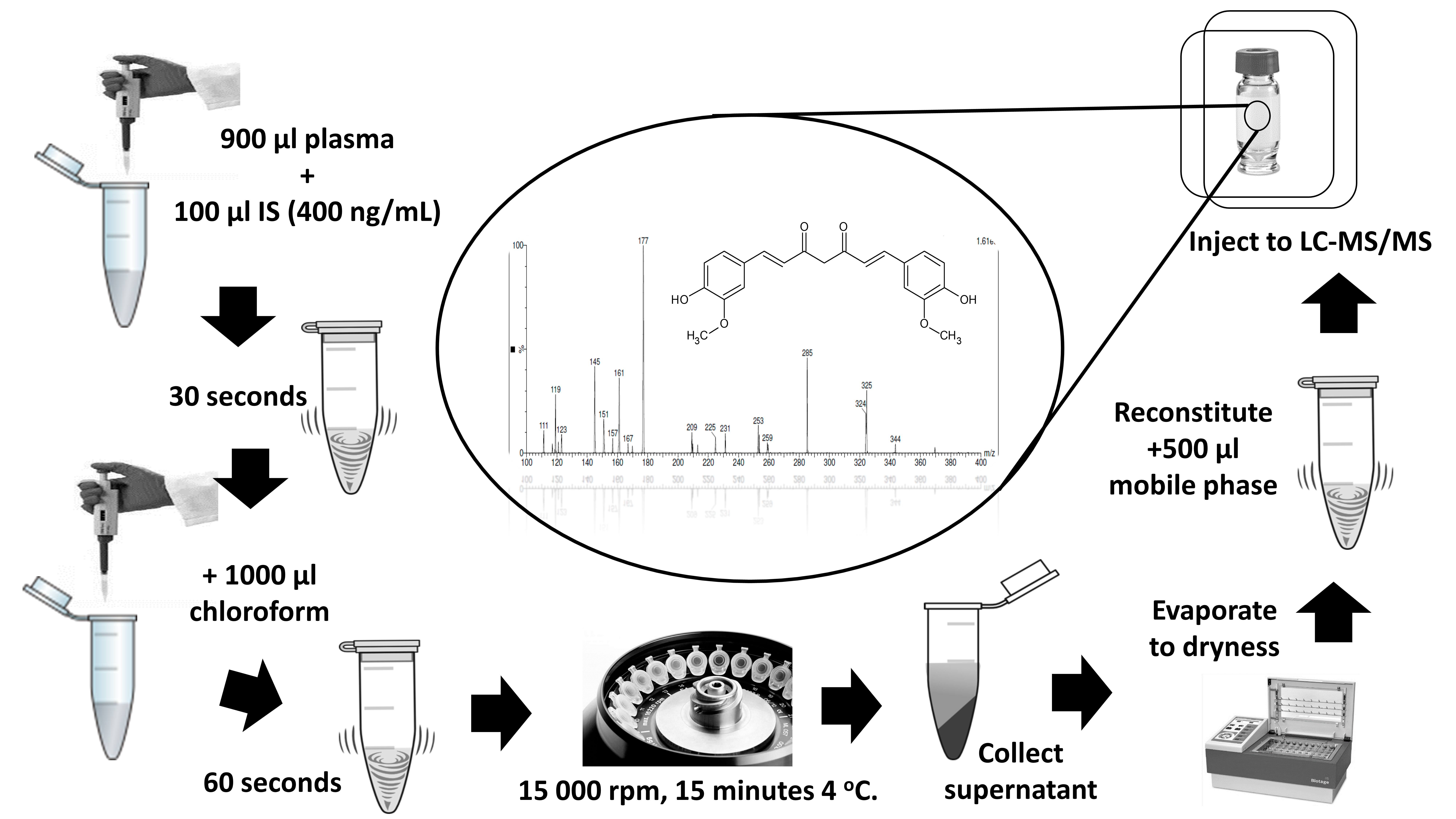
Abstract. Curcumin has gained great attention in the last decades due to its fascinating properties for humans, such as anti-inflammatory or as cytotoxic against cancer. These effects are also claimed for pets such as cats and dogs, where curcumin administration is a daily practice routine. However, curcumin presents poor oral bioavailability, driving scientists to look for new delivery systems. In the last decades, several analytical methods for the quantification of curcumin in plasma have been published. To our knowledge there are no published reports on the effect of the level of hemolysis in the determination of this compound. In the present paper, a highly specific, sensitive and selective method is presented using Molecular Reaction Monitoring (SRM) using positive ionization (ESI+) mode. Curcumin and clopidogrel bisulfate – used as internal standard (IS) – were separated on an Acquity UPLC BECH Shield RP 18 column (1.7µm, 2.1 X 100mm) with 0.1% formic acid in acetonitrile and water in proportion of 60:40 (v/v). The analyte transitions were 369.3→177.06 m/z for curcumin and 322→212.05 m/z for IS. The method was fully validated and showed good linearity (R2 ≥ 0.999) over the range of 3-160 ng/mL. The Relative Standard Deviation (RSD) were less than 6% for intra-and inter-day analysis and recovery spanned 85-95%. We proved that the degree of hemolysis impaired curcumin quantitation. This method was applied to test curcumin bioavailability in both a mucoadhesive nanocapsule formulation and traditional capsules in dogs that attended routine veterinary consultation.
Resumen. La curcumina ha ganado gran atención en las últimas décadas debido a sus propiedades terapéuticas para los humanos, como antiinflamatorio o citotóxico contra el cáncer. Estos efectos también se observan en pequeñas especies como gatos y perros, donde la administración de curcumina se ha vuelto una alternativa. Sin embargo, la curcumina presenta una baja biodisponibilidad oral, lo que impulsa a los científicos a buscar nuevos sistemas de administración. En las últimas décadas, se han publicado varios métodos analíticos para la cuantificación de curcumina en plasma. Actualmente, no hay informes publicados sobre el efecto del grado de hemólisis en la determinación de este compuesto. En este trabajo se desarrolló un método específico, sensible y selectivo utilizando el Monitoreo de reacción seleccionado (SRM) en modo de ionización positiva (ESI +). La curcumina y el bisulfato de clopidogrel, utilizado como patrón interno (IS), se separaron en una columna Acquity UPLC BECH Shield RP 18 (1,7 μm, 2,1 X 100 mm) con ácido fórmico al 0,1% en acetonitrilo y agua a una proporción de 60:40 (v/v). Las transiciones de los analitos fueron 369.3 → 177.06 m/z para curcumina y 322 → 212.05 m/z para IS. El método fue validado y demostró ser lineal (r2 ≥ 0.999) en el rango de 3-160 ng/mL. La desviación relativa estándar (RSD) fue inferior al 6% para el análisis intra e interdía y el porcentaje de recuperación fue 85-95%. Se descubrió que el grado de hemólisis afecta la cuantificación de curcumina. El método desarrollado se aplicó para evaluar la biodisponibilidad de curcumina tanto en una formulación de nanocápsulas mucoadhesivas como en cápsulas tradicionales en perros que asistieron a consultas veterinarias de rutina.
Downloads
References
Noorafshan, A.; Ashkani-Esfahani, S., Curr Pharm Des 2013, 19 (11), 2032-46. DOI: https://doi.org/10.2174/1381612811319110006
Vaughn, A. R.; Branum, A.; Sivamani, R. K., Phytother Res 2016, 30 (8), 1243-64. DOI: 10.1002/ptr.5640. DOI: https://doi.org/10.1002/ptr.5640
Nguyen, T. A.; Friedman, A. J., J Drugs Dermatol 2013, 12 (10), 1131-7.
Aggarwal, B. B.; Harikumar, K. B., Int J Biochem Cell Biol 2009, 41 (1), 40-59. DOI: 10.1016/j.biocel.2008.06.010 DOI: https://doi.org/10.1016/j.biocel.2008.06.010
Mantzorou, M.; Pavlidou, E.; Vasios, G.; Tsagalioti, E.; Giaginis, C., Phytother Res 2018. DOI: 10.1002/ptr.6037 DOI: https://doi.org/10.1002/ptr.6037
Basnet, P.; Skalko-Basnet, N., Molecules 2011, 16 (6), 4567-98. DOI: 10.3390/molecules16064567 DOI: https://doi.org/10.3390/molecules16064567
Zhang, S.; Zou, J.; Li, P.; Zheng, X.; Feng, D., J Agric Food Chem 2018, 66 (2), 449-456. DOI: 10.1021/acs.jafc.7b04260 DOI: https://doi.org/10.1021/acs.jafc.7b04260
Aggarwal, B. B. S., Young-Joon. Shishodia, S., The Molecular Targets and Therapeutic Uses of Curcumin in Health and Disease. Springer US: 2007; p 490. DOI: https://doi.org/10.1007/978-0-387-46401-5
Sgorlon, S.; Stefanon, B.; Sandri, M.; Colitti, M., Res Vet Sci 2016, 109, 142-148. DOI: 10.1016/j.rvsc.2016.10.005 DOI: https://doi.org/10.1016/j.rvsc.2016.10.005
Castrogiovanni, P.; Trovato, F. M.; Loreto, C.; Nsir, H.; Szychlinska, M. A.; Musumeci, G., Int J Mol Sci 2016, 17 (12). DOI:10.3390/ijms17122042 DOI: https://doi.org/10.3390/ijms17122042
Helson, L.; Bolger, G.; Majeed, M.; Vcelar, B.; Pucaj, K.; Matabudul, D., Anticancer Res 2012, 32 (10), 4365-70.
Prasad, S.; Tyagi, A. K.; Aggarwal, B. B., Cancer Res Treat 2014, 46 (1), 2-18. DOI: 10.4143/crt.2014.46.1.2 DOI: https://doi.org/10.4143/crt.2014.46.1.2
Vareed, S. K.; Kakarala, M.; Ruffin, M. T.; Crowell, J. A.; Normolle, D. P.; Djuric, Z.; Brenner, D. E., Cancer Epidemiol Biomarkers Prev 2008, 17 (6), 1411-7. DOI: 10.1158/1055-9965 DOI: https://doi.org/10.1158/1055-9965.EPI-07-2693
Herebian, D.; Choi, J. H.; Abd El-Aty, A. M.; Shim, J. H.; Spiteller, M., Biomed Chromatogr 2009, 23 (9), 951-65. DOI: 10.1002/bmc.1207 DOI: https://doi.org/10.1002/bmc.1207
Avula, B.; Wang, Y.-H.; Khan, I. A., Journal of Chromatography & Separation Techniques. 2012, 3 (1), 3-8. DOI: 10.4172/2157-7064.1000120 DOI: https://doi.org/10.4172/2157-7064.1000120
Ashraf, K.; Mujeeb, M.; Ahmad, A.; Ahmad, N.; Amir, M., J Chromatogr Sci 2015, 53 (8), 1346-52. DOI: 10.1093/chromsci/bmv023 DOI: https://doi.org/10.1093/chromsci/bmv023
Cao, Y.; Xu, R. X.; Liu, Z., J Chromatogr B Analyt Technol Biomed Life Sci 2014, 949-950, 70-8. DOI: 10.1016/j.jchromb.2013.12.039 DOI: https://doi.org/10.1016/j.jchromb.2013.12.039
Ramalingam, P.; Ko, Y. T., J Chromatogr B Analyt Technol Biomed Life Sci 2014, 969, 101-8. DOI: 10.1016/j.jchromb.2014.08.009 DOI: https://doi.org/10.1016/j.jchromb.2014.08.009
Hao, K.; Zhao, X. P.; Liu, X. Q.; Wang, G. J., Chromatographia 2006, 64 (9-10), 531-535. DOI: 10.1365/s10337-006-0047-z DOI: https://doi.org/10.1365/s10337-006-0047-z
Yang, K. Y.; Lin, L. C.; Tseng, T. Y.; Wang, S. C.; Tsai, T. H., J Chromatogr B Analyt Technol Biomed Life Sci 2007, 853 (1-2), DOI: 183-9. 10.1016/j.jchromb.2007.03.010 DOI: https://doi.org/10.1016/j.jchromb.2007.03.010
Pawar, Y. B.; Shete, G.; Popat, D.; Bansal, A. K., Eur J Pharm Sci 2012, 47 (1), 56-64. DOI: 10.1016/j.ejps.2012.05.003 DOI: https://doi.org/10.1016/j.ejps.2012.05.003
Liu, Y.; Siard, M.; Adams, A.; Keowen, M. L.; Miller, T. K.; Garza, F.; Andrews, F. M.; Seeram, N. P., J Pharm Biomed Anal 2018, 154, 31-39. DOI: 10.1016/j.jpba.2018.03.014 DOI: https://doi.org/10.1016/j.jpba.2018.03.014
Singh S. P., W.; Jain, G. K., Journal of Bioanalysis & Biomedicine. 2010, 2 (4), 79-84. DOI: 10.4172/1948-593X.1000027 DOI: https://doi.org/10.4172/1948-593X.1000027
Li, R.; Qiao, X.; Li, Q.; He, R.; Ye, M.; Xiang, C.; Lin, X.; Guo, D., J Chromatogr B Analyt Technol Biomed Life Sci 2011, 879 (26), 2751-8. DOI: 10.1016/j.jchromb.2011.07.042 DOI: https://doi.org/10.1016/j.jchromb.2011.07.042
Ma, W.; Wang, J.; Guo, Q.; Tu, P., J Pharm Biomed Anal 2015, 111, 215-21. DOI: 10.1016/j.jpba.2015.04.007 DOI: https://doi.org/10.1016/j.jpba.2015.04.007
Chen, Z.; Sun, D.; Bi, X.; Zeng, X.; Luo, W.; Cai, D.; Zeng, Q.; Xu, A., Phytomedicine 2017, 27, 15-22. DOI: 10.1016/j.phymed.2017.01.012 DOI: https://doi.org/10.1016/j.phymed.2017.01.012
The European Agency for the Evaluation of Medicinal Products. VICH Topic GL1. Guideline on validation of analytical procedures:definition and terminology. London, UK. CVMP/VICH/590/98-FINAL, 1998.
The European Agency for the Evaluation of Medicinal Products. VICH Topic GL2. Guideline on validation of analytical procedures: methodology. London, UK. CVMP/VICH/591/98-FINAL, 1998.
Wahlang, B.; Pawar, Y. B.; Bansal, A. K., Eur J Pharm Biopharm 2011, 77 (2), 275-82. DOI: 10.1016/j.ejpb.2010.12.006 DOI: https://doi.org/10.1016/j.ejpb.2010.12.006

Downloads
Published
Issue
Section
License
Authors who publish with this journal agree to the following terms:
- Authors retain copyright and grant the journal right of first publication with the work simultaneously licensed under a Creative Commons Attribution License that allows others to share the work with an acknowledgement of the work's authorship and initial publication in this journal.
- Authors are able to enter into separate, additional contractual arrangements for the non-exclusive distribution of the journal's published version of the work (e.g., post it to an institutional repository or publish it in a book), with an acknowledgement of its initial publication in this journal.









