Analysis of Red Amaranth (Amaranthus cruentus L.) Betalains by LC-MS
DOI:
https://doi.org/10.29356/jmcs.v67i3.1967Keywords:
Amaranth, betacyanins, betaxanthins, high-performance liquid chromatography, tandem mass spectrometryAbstract
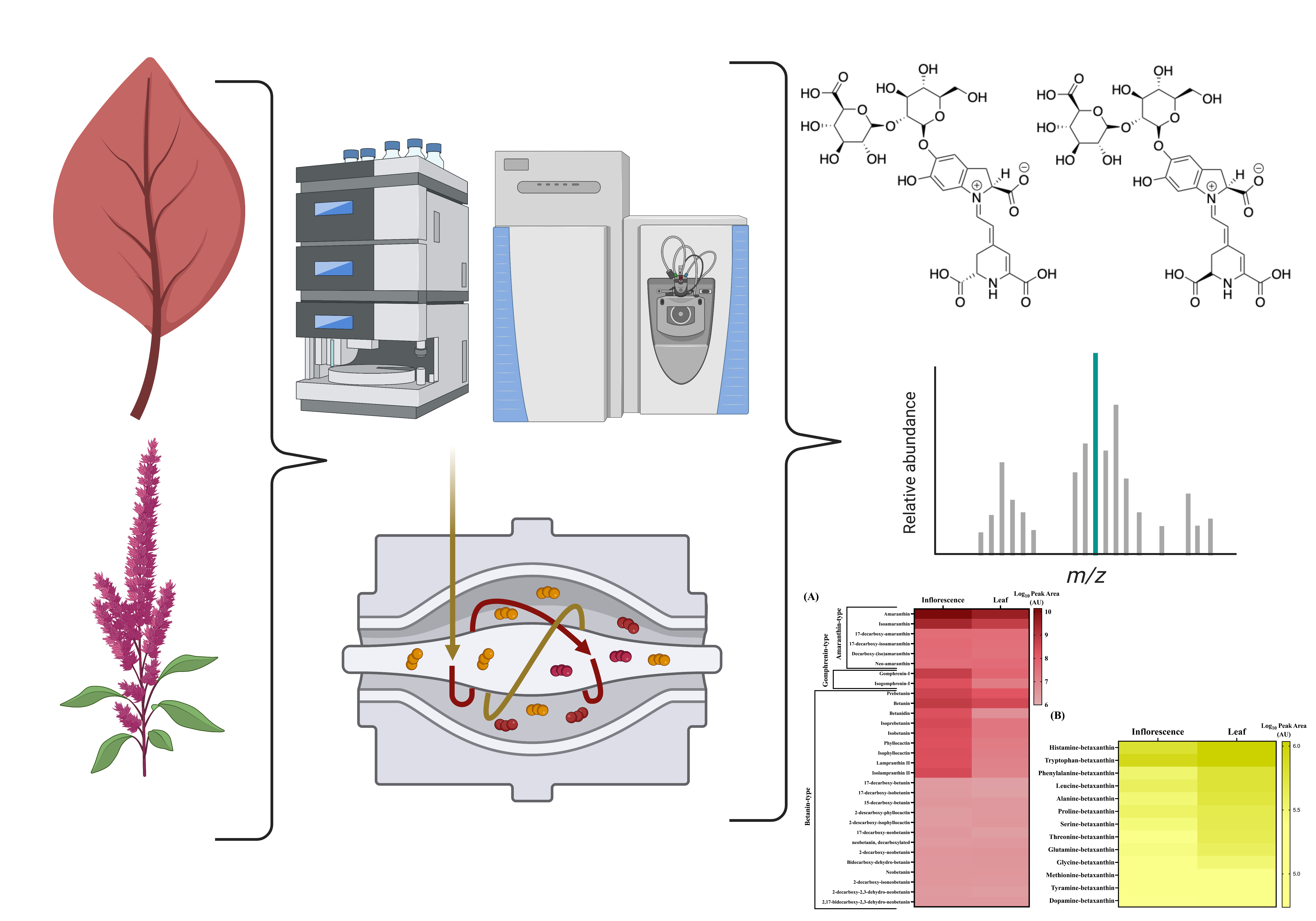
Abstract. Betalains are natural pigments responsible for the colour of flowers, bracts, stems, and leaves of genus Amaranthus, and they are bioactive compounds. Due to their great chemical diversity, the determination and confident identification of betalains are still challenges and of great interest as they are natural colourants for health benefit. By high-performance liquid chromatography (LC) coupled to tandem mass spectrometry (MS), the catalog of betalains in red amaranth (Amaranthus cruentus L.) was defined. In total, 30 betacyanins and 13 betaxanthins were found. Mass measurements for the parent ion and for its fragments with errors of less than 5 parts per million (ppm) achieved the recommended criteria for identification of compounds. This work defines the main betalains in red amaranth (A. cruentus) and valorizes the leaves and inflorescence of red amaranth as betalain pigments sources.
Resumen. Las betalaínas son pigmentos naturales responsables del color en las flores, brácteas, tallos y hojas del género Amaranthus y también son compuestos bioactivos. Debido a su amplia diversidad química, la identificación y determinación confiable de betalaínas siguen siendo desafíos y son de gran interés puesto que son colorantes naturales beneficiosos para la salud. Por medio de cromatografía de líquidos de alta eficiencia acoplada a espectrometría de masas en tándem se definió el catálogo de betalaínas en “amaranto rojo” (Amaranthus cruentus L.). En total se encontraron 30 betacianinas y 13 betaxantinas. Las mediciones de las masas del ion molecular y sus fragmentos con errores menores a 5 partes por millón (ppm) garantizaron los criterios recomendados para la identificación de compuestos. Este trabajo define las principales betalaínas del amaranto rojo (A. cruentus) y valora las hojas e inflorescencias del amaranto rojo como fuente de pigmentos betalaínicos.
Downloads
References
Stafford, H. A. Plant Science. 1994, 101, 91–98. DOI: https://doi.org/10.1016/0168-9452(94)90244-5.
Stintzing, F.; Schliemann, W. Z. Naturforsch., C: J. Biosci. 2007, 62, 779–785. DOI: https://doi.org/10.1515/znc-2007-11-1201.
Contreras-Llano, L. E.; Guerrero-Rubio, M. A.; Lozada-Ramírez, J. D.; García-Carmona, F.; Gandía-Herrero, F. mBio. 2019, 10, e00345–19. DOI: https://doi.org/10.1128/mBio.00345-19.
Kumorkiewicz-Jamro, A.; Świergosz, T.; Sutor, K.; Spórna-Kucab, A.; Wybraniec, S. Nat. Prod. Rep. 2021, 38, 2315–2346. DOI: https://doi.org/10.1039/d1np00018g.
Kadereit, G.; Borshc, T.; Weising, K.; Freitag, H. Int. J. Plant Sci. (Chicago, IL, U. S.). 2003, 164, 959–986. DOI: https://doi.org/10.1086/378649.
Sauer, J. D. Ann. Mo. Bot. Gard. 1967, 54, 103–137. DOI: https://doi.org/10.2307/2394998.
Hernández-Ledesma, P.; Berendsohn, W. G.; Borsch, T.; et al. Willdenowia. 2015, 45, 281–383. DOI: https://doi.org/10.3372/wi.45.45301.
Sauer, J. D. Am. Antiq. 1969, 34, 80–81. DOI: https://doi.org/10.2307/278318.
Joshi, D. C.; Sood, S.; Hosahatti, R.; Kant, L.; Pattanayak, A.; Kumar, A.; Yadav, D.; Stetter, M. G. Theor. Appl. Genet. 2018, 131, 1807–1823. DOI: https://doi.org/10.1007/s00122-018-3138-y.
Szabóová, M.; Záhorský, M.; Gažo, J.; Geuens, J.; Vermoesen, A.; D'Hondt, E.; Hricová, A.; Plants. 2020, 9, 1412. DOI: https://doi.org/10.3390/plants9111412.
Schnetzler, K. A. Food Uses and Amaranth Product Research: A Comprehensive Review. In Amaranth Biology, Chemistry, and Technology, 1st ed.; Paredes-Lopez, O., Ed; CRC Press: Boca Raton, FL, 1994, Chapter 9, 155–184. DOI: https://doi.org/10.1201/9781351069601-9
Pucher, G. W.; Curtis, L. C.; Vickery, H. B. J. Biol. Chem. 1938, 123, 61–70. DOI: https://doi.org/10.1016/S0021-9258(18)74155-0.
Khan, M. I.; Giridhar, P. Phytochemistry. 2015, 117, 267–295. DOI: https://doi.org/10.1016/j.phytochem.2015.06.008
Sadowska-Bartosz, I.; Bartosz, G. Molecules. 2021, 26, 2520. DOI: https://doi.org/10.3390/molecules26092520.
Belhadj Slimen, I.; Najar, T.; Abderrabba, M. J. Agric. Food Chem. 2017, 65, 675–689. DOI: https://doi.org/10.1021/acs.jafc.6b04208.
Tang, Y.; Tsao, R. Mol. Nutr. Food Res. 2017, 61, 1600767. DOI: https://doi.org/10.1002/mnfr.201600767. DOI: https://doi.org/10.1002/mnfr.201770103
Fu, Y.; Shi, J.; Xie, S. Y.; Zhang, T. Y.; Soladoye, O. P.; Aluko, R. E. J. Agric. Food Chem. 2020, 68, 11595–11611. DOI: https://doi.org/10.1021/acs.jafc.0c04241.
Khan, M. I. Food Chem. 2016, 197, 1280–1285. DOI: https://doi.org/10.1016/j.foodchem.2015.11.043.
Cai, Y.; Sun, M.; Wu, H.; Huang, R.; Corke, H. J. Agric. Food Chem. 1998, 46, 2063–2070. DOI: https://doi.org/10.1021/jf9709966.
Xie, G. R.; Chen H. J. J. Agric. Food Chem. 2021, 69, 15699–15715. DOI: https://doi.org/10.1021/acs.jafc.1c06596.
Stintzing, F. C.; Carle, R. Trends Food Sci. Technol. 2004, 15, 19–38. DOI: https://doi.org/10.1016/j.tifs.2003.07.004
Schwartz, S. J.; von Elbe, J. H. J. Agric. Food Chem. 1980, 28, 540–543, DOI: https://doi.org/10.1021/jf60229a032.
Gonçalves, L. C. P.; Trassi, M. A. D. S.; Lopes, N. B.; Dörr, F. A.; Santos, M. T. D.; Baader, W. J.; Oliveira, V. X.; Bastos, E. L. Food Chem. 2012, 131, 231–238. DOI: https://doi.org/10.1016/j.foodchem.2011.08.067.
Cai, Y.; Sun, M.; Corke, H. J. Agric. Food Chem. 2001, 49, 1971–1978, DOI: https://doi.org/10.1021/jf000963h.
Howard, J. E.; Villamil, M. B.; Riggins, C. W. Front. Plant Sci. 2022, 13. DOI: https://doi.org/10.3389/fpls.2022.932440.
Kugler, F.; Stintzing, F. C.; Carle, R. Anal. Bioanal. Chem. 2007, 387, 637–648. DOI: https://doi.org/10.1007/s00216-006-0897-0.
Schliemann, W.; Cai, Y.; Degenkolb, T.; Schmidt, J.; Corke, H. Phytochemistry. 2001, 58, 159–165. DOI: https://doi.org/10.1016/s0031-9422(01)00141-8.
Sutor, K.; Wybraniec, S. J. Agric. Food Chem. 2020, 68, 11459–11467. DOI: https://doi.org/10.1021/acs.jafc.0c04746.
Kusznierewicz, B.; Mróz, M.; Koss-Mikołajczyk, I.; Namieśnik, J. Food Chem. 2021, 362, 130132. DOI: https://doi.org/10.1016/j.foodchem.2021.130132.
Slatnar, A.; Stampar, F.; Veberic, R.; Jakopic, J. J. Food Sci. 2015, 80, C1952–8. DOI: https://doi.org/10.1111/1750-3841.12977.
Wybraniec, S. J. Agric. Food Chem. 2005, 53, 3483–7. DOI: https://doi.org/10.1021/jf048088d.
Kumorkiewicz, A.; Wybraniec, S. J. Agric. Food Chem. 2017, 65, 7500–7508. DOI: https://doi.org/10.1021/acs.jafc.7b02357.
Sarker, U.; Oba, S.; Alsanie, W.F.; Gaber, A. Antioxidants. 2022, 11, 1089. DOI: https://doi.org/10.3390/antiox11061089.
Wang, M.; Lopez-Nieves, S.; Goldman, I. L.; Maeda, H. J. Agric. Food Chem. 2017, 65, 4305–4313. DOI: https://doi.org/10.1021/acs.jafc.7b00810.
Polturak, G.; Aharoni, A. Mol. Plant. 2018, 11, 7–22. DOI: https://doi.org/10.1016/j.molp.2017.10.008.
Timoneda, A.; Feng, T.; Sheehan, H.; Walker-Hale, N.; Pucker, B.; Lopez-Nieves, S.; Guo, R.; Brockington, S. New Phytol. 2019, 224, 71–85. DOI: https://doi.org/10.1111/nph.15980.
Avila-Nava, A.; Alarcón-Telésforo, S. L.; Talamantes-Gómez, J. M.; Corona, L.; Gutiérrez-Solis, A. L.; Lugo, R.; Márquez-Mota, C. C. Molecules. 2022, 27, 7397. DOI: https://doi.org/10.3390/molecules27217397.
Coelho, L. M.; Faria, C.; Madalena, D.; Genisheva, Z.; Martins, J. T.; Vicente, A. A.; Pinheiro, A. C. Molecules. 2022, 27, 5798. DOI: https://doi.org/10.3390/molecules27185798.

Downloads
Published
Issue
Section
License
Copyright (c) 2023 Jesús Alfredo Araujo-León, Victor Aguilar-Hernández, Ivonne Sánchez-del Pino, Ligia Brito-Argáez, Sergio R. Peraza-Sánchez, Andrés Xingú-López, Rolffy Ortiz-Andrade

This work is licensed under a Creative Commons Attribution-NonCommercial 4.0 International License.
Authors who publish with this journal agree to the following terms:
- Authors retain copyright and grant the journal right of first publication with the work simultaneously licensed under a Creative Commons Attribution License that allows others to share the work with an acknowledgement of the work's authorship and initial publication in this journal.
- Authors are able to enter into separate, additional contractual arrangements for the non-exclusive distribution of the journal's published version of the work (e.g., post it to an institutional repository or publish it in a book), with an acknowledgement of its initial publication in this journal.









