Nanoencapsulation of Antifungal Piper schlechtendalii Extract in Poly(lactide-co-glycolic) Acid to Enhance Photostability
DOI:
https://doi.org/10.29356/jmcs.v68i2.1964Keywords:
Fusarium, Plant extract, Biodegradable polymer, Pesticide, Colloidal suspensionAbstract
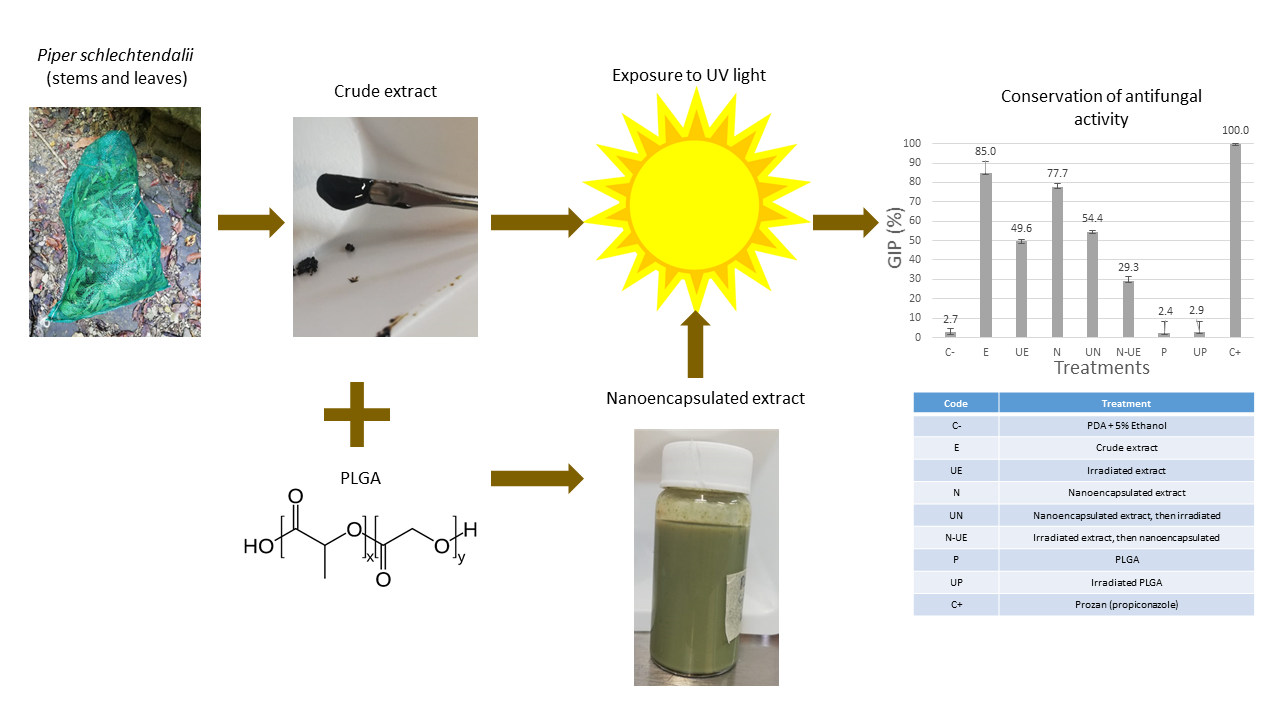
Abstract. Synthetic fungicides are used to control fungal diseases in plants, such as those caused by members of the Fusarium genus. Nonetheless, the over-application of synthetic formulations can generate other problems, like phytotoxicity, or the pollution of water and soil. In this context, botanical extracts with antifungal properties can represent an environmentally friendly alternative to control fungal infections. The application of natural products in the form of crude extracts still requires the incorporation of toxic organic solvents to be used as vehicle. Nanotechnology allows the dispersion of hydroalcoholic extracts in water simply by the nanoencapsulation of the active molecules in a biodegradable polymer, with the advantage that no organic solvents are required while, at the same time, this polymer may protect the extract against photodegradation. The present study aims to encapsulate an antifungal Piper schlechtendalii crude extract in poly(lactide-co-glycolide) acid nanospheres, conferring good dispersion in water while protecting the active ingredients against degradation by solar irradiation. The particle size, zeta potential, and encapsulation efficiency obtained were 170 nm, -37 mV, and 33.7 %, respectively. The system obtained showed good dispersion in water, in the form of a colloidal suspension of polymeric nanospheres. After 24 h of exposure to UV-A radiation, crude extract only retained 58.35 % of its original Fusarium solani growth inhibition capacity, while the nanoencapsulated extract retained 70 %. The study concluded that the biodegradable polymer does confer photoprotection to the active ingredients in the antifungal Piper extract while simultaneously removing the necessity of organic solvents as vehicles, potentially reducing the environmental impact.
Resumen. Los fungicidas sintéticos son usados para controlar enfermedades fúngicas en plantas, como aquellas causadas por el género Fusarium. Sin embargo, la aplicación desmedida de formulaciones sintéticas puede generar otros problemas, como fitotoxicidad, o contaminación de agua y suelos. En este contexto, extractos botánicos con propiedades antifúngicas representan una alternativa ecológicamente amigable para controlar infecciones fúngicas. La aplicación de productos naturales en forma de extractos crudos aún requiere la incorporación de disolventes orgánicos tóxicos para ser utilizados como vehículos. La nanotecnología permite la dispersión de extractos hidroalcóholicos en agua simplemente nanoencapsulando las moléculas activas en polímeros biodegradables, con la ventaja de que no requiere disolventes orgánicos mientras que, a la vez, dicho polímero protege al extracto contra fotodegradación. El presente estudio busca encapsular un extracto crudo antifúngico de Piper schlechtendalii en nanoesferas de poli(ácido láctico-co-glicólico), brindando buena dispersión en agua mientras se protege a los ingredientes activos contra degradación por luz solar. El tamaño de partícula, potencial zeta, y eficiencia de encapsulación obtenidos fueron 170 nm, -37 mV, y 33.7 %, respectivamente. El sistema obtenido mostró buena dispersión en agua, en forma de una suspensión coloidal de nanoesferas poliméricas. Después de 24 h de exposición a radiación UV-A, el extracto crudo solo retuvo 58.35 % de su inhibición de crecimiento de Fusarium solani original mientras que el extracto nanoencapsulado retuvo el 70 %. El estudio concluyó que el polímero biodegradable logra brindar fotoprotección a los ingredientes activos del extracto de Piper mientras que, simultáneamente, remueve la necesidad de usar disolventes orgánicos como vehículo, reduciendo potencialmente el impacto ambiental.
Downloads
References
Ghormade, V.; Deshpande, M. V.; Paknikar, K. M. Biotechnol. Adv. 2011, 29, 792−803. DOI: http://dx.doi.org/10.1016/j.biotechadv.2011.06.007. DOI: https://doi.org/10.1016/j.biotechadv.2011.06.007
Van den Berg, F.: Kubiak, R.; Benjey, W. G.; Majewski. M. S.; Yates, S. R.; Reeves, G. L.; Smelt, J. H.; Van der Linden, A. M. A. Water, Air, Soil. Pollut. 1999, 115, 195−218. DOI: https://doi.org/10.1023/A:1005234329622. DOI: https://doi.org/10.1007/978-94-017-1536-2_9
Bedos, C.; Cellier, P.; Calvet, R.; Barriuso, E. Agronomie. 2002, 22, 35−49. DOI: http://dx.doi.org/10.1051/agro:2001004. DOI: https://doi.org/10.1051/agro:2001004
Mogul, M. G.; Akin, H.; Hasirci, N.; Trantolo, D. J.; Gresser, D.; Wise, D. L. Resour. Conserv. Recy. 1996, 16, 289−320. DOI: https://doi.org/10.1016/0921-3449(95)00063-1
Nair, R.; Varghese, S. H.; Nair, B. G.; Maekawa, T.; Yoshida, Y.; Kumar, D. S. Nanoparticulate material delivery to plants. Plant. Sci. 2010, 179, 154−163. DOI: http://dx.doi.org/10.1016/j.plantsci.2010.04.012. DOI: https://doi.org/10.1016/j.plantsci.2010.04.012
Korsukova, A. V.; Gornostai, T. G.; Grabeinych, O. I.; Dorofeev, N. V.; Pobezhimova, T. P.; Sokolova, N. A.; Dudareva, L. V.; Voinikov, V. K. J. Stress Physiol. Biochem. 2016, 12, 72–79.
Balakumar, S.; Rajan, S.; Thirunalasundari, T.; Jeeva, S. Asian Pac. J. Trop. Biomed. 2011, 1, 309-12. DOI: http://dx.doi.org/10.1016/S2221-1691(11)60049-X. DOI: https://doi.org/10.1016/S2221-1691(11)60049-X
Gahukar, R. T. Crop Prot. 2012, 42, 202-9. DOI: http://dx.doi.org/10.1016/j.cropro.2012.07.026. DOI: https://doi.org/10.1016/j.cropro.2012.07.026
Gillitzer, P.; Martin, A. C.; Kantar, M.; Kauppi, K.; Dahlberg, S.; Lis, D.; Kurle, J.; Sheaffer, C.; Wyse, D. J. Med. Plants Res. 2012, 6, 938-49. DOI: http://dx.doi.org/10.5897/JMPR10.710. DOI: https://doi.org/10.1007/s12155-012-9233-z
Tangarife-Castaño, V.; Correa-Royero, J. B.; Roa-Linares, V. C.; Pino-Benitez, N.; Betancur-Galvis, L. A.; Durán, D. C.; Mesa-Arango, A. C. J. Essent. Oil Res. 2014, 26, 221-227. DOI: https://doi.org/10.1080/10412905.2014.882279.
Matasyoh, J. C., Wagara, I. N.; Nakavuma, J. L.; Chepkorir, R. Int. J. Biol. Chem. 2013, 7, 1441-1451. DOI: http://dx.doi.org/10.4314/ijbcs.v7i4.2. DOI: https://doi.org/10.4314/ijbcs.v7i4.2
Da Silva, J. K. R.; Silva, J. R. A.; Nascimento, S. B.; Da Luz, S. F.; Meireles, E. N.; Alves, C. N.; Maia, J. G. S. Molecules. 2014, 19, 17926-17942. DOI: https://doi.org/10.3390/molecules191117926.
Pineda, R.; Vizcaíno, S.; García C. M., Gil J. H.; Durango, D. L. Chil. J. Agric. Res. 2012, 72, 507-515. DOI: https://doi.org/10.4067/S0718-58392012000400008
Parra, J. E.; Delgado, W. A.; Cuca, L. E. Phytochem. Lett. 2011, 4, 280-282. DOI: 10.1016/j.phytol.2011.04.015. DOI: https://doi.org/10.1016/j.phytol.2011.04.015
Ee, G. C.; Lim, C. M.; Lim, C. K.; Rahmani, M.; Shaari, K.; Bong, C. F. J. Nat. Prod. Res. 2009, 23, 1416–1423. DOI: http://dx.doi.org/10.1080/14786410902757998. DOI: https://doi.org/10.1080/14786410902757998
Scott, I. M.; Puniani, E.; Jensen, H.; Livesey, J. F.; Poveda, L.; Sanchez-Vindas, P.; Durst, T.; Arnason, J. T. J. Agric. Food Chem. 2005, 53, 1907–1913. DOI: http://dx.doi.org/10.1021/jf048305a. DOI: https://doi.org/10.1021/jf048305a
Meireles, E.; Xavier, L. J. Plant Pathol. Microbiol. 2016, 7. DOI: https://doi.org/10.4172/2157-7471.1000333.
Nascimento, S.; de Mattos Cascardo, J.; de Menezes, I.; Reis Duarte, M.; Darnet, S.; Harada, M.; de Souza, C. Protein Pept. Lett. 2009, 16, 1429–1434. DOI: https://doi.org/10.2174/092986609789839368.
Fernández, M. D. S.; Hernández-Ochoa, F.; Carmona-Hernández, O.; Luna-Rodríguez, M.; Barrientos-Salcedo, C.; Asselin, H.; Lozada-García, J. A. Rev. Mex. Fitopatol. 2020, 39, 198–206. DOI: https://doi.org/10.18781/r.mex.fit.2006-6.
Al Aboody, M. S.; Mickymaray, S. Antibiotics (Basel) 2020, 9, 45. DOI: https://doi.org/10.3390/antibiotics9020045.
Parmar, V. S.; Jain, S. C.; Bisht, K. S.; Jain, R.; Taneja, P.; Jha, A.; Tyagi, O. D.; Prasad, A. K.; Wengel, J.; Olsen, C. E.; Boll, P. M. Phytochemistry. 1997, 46, 597–673. DOI: https://doi.org/10.1016/s0031-9422(97)00328-2.
Nuruzzaman, M.; Mahmudur, M. M.; Liu, Y.; Naidu, R. Agric. Food Chem. 2016, 64, 1447−1483. DOI: http://dx.doi.org/10.1021/acs.jafc.5b05214. DOI: https://doi.org/10.1021/acs.jafc.5b05214
Anderson, J. M.; Shive, M. S. Adv. Drug Deliv. Rev. 1997, 28, 5–24. DOI: http://dx.doi.org/10.1016/s0169-409x(97)00048-3. DOI: https://doi.org/10.1016/S0169-409X(97)00048-3
Astete, C. E.; Sabliov, C. M. J. Biomater. Sci. Polym. Ed. 2006, 17, 247–289. DOI: http://dx.doi.org/10.1163/156856206775997322. DOI: https://doi.org/10.1163/156856206775997322
Park, T. G. Biomaterials. 1995, 16, 1123–1130. DOI: http://dx.doi.org/10.1016/0142-9612(95)93575-x. DOI: https://doi.org/10.1016/0142-9612(95)93575-X
Stevanovic, M. M.; Uskokovic, D. P. Curr. Nanosci. 2009, 5, 1–14. DOI: 10.2174/157341309787314566. DOI: https://doi.org/10.2174/157341309787314566
Oliveira, D. A.; Angonese, M.; Ferreira, S. R. S.; Gomes, C. L. Food Bioprod. Process. 2017, 104, 137–146. DOI: http://dx.doi.org/10.1016/j.fbp.2017.05.009. DOI: https://doi.org/10.1016/j.fbp.2017.05.009
Chopra, D.; Ray, L.; Dwivedi, A.; Tiwari, S. K.; Singh, J.; Singh, K. P.; Kushwaha, H. N.; Jahan, S.; Pandey, A.; Gupta, S. K.; Chaturvedi, R. K.; Pant, A. B.; Ray, R. S.; Gupta, K. C. Biomaterials. 2016, 84, 25-41. DOI: http://dx.doi.org/10.1016/j.biomaterials.2016.01.018.
Ahmad, W.; Kumar, P.; Chaturvedi, A. K. J. Pharm. Phytochem. 2019, 8, 1737-1740. DOI: https://doi.org/10.1109/TENCON.2019.8929688
Hwisa, N.; Katakam, P.; Rao, B.; Kumari, S. VRI Biol. Med. Chem. 2013, 1, 8-22. DOI: http://dx.doi.org/10.14259/bmc.v1i1.29. DOI: https://doi.org/10.14259/bmc.v1i1.29
Guntero, V. A.; Longo, M. B.; Ciparicci, S.; Martini, R. E.; Andreatta, A. E. in: Comparison of extraction methods of polyphenols from waste from the wine industry. CAIQ2015-VII Argentine Congress of chemical engineering. 3rd. Argentine Conference on process safety. 2015
Monribot-Villanueva, J. L.; Elizalde-Contreras, J. M.; Aluja, M. Segura-Cabrera, A.; Birke, A.; Guerrero-Analco, J. A.; Ruiz-May, E. Food Chem. 2019, 285, 119–129. DOI: http://dx.doi.org/10.1016/j.foodchem.2019.01.136. DOI: https://doi.org/10.1016/j.foodchem.2019.01.136
Pang, Z.; Chong, J.; Zhou, G.; Morais, D.; Chang, L.; Barrette, M.; Gauthier, C.; Jacques, P. E.; Li, S.; Xia, J. Nucl. Acids Res. 2021, 49, 388-396. DOI: http://dx.doi.org/10.1093/nar/gkab382. DOI: https://doi.org/10.1093/nar/gkab382
Scharma, K. K.; Singh, U. S.; Sharma, P.; Kumar, A. J. Appl. Nat. Sci. 2015, 7, 521-539. DOI: http://dx.doi.org/https://doi.org/10.31018/jans.v7i1.641.
Vert, M.; Mauduit, J.; Li, S. Biomaterials. 1994, 15, 209-1213. DOI: https://doi.org/10.1016/0142-9612(94)90271-2
Kemme, M.; Prokesch, I.; Heinzel-Wieland, R. Polym. Test. 2011, 30, 743-748. DOI: https://doi.org/10.1016/j.polymertesting.2011.06.009.
Cai, Q.; Bei, J.; Luo, A.; Wang, S. Polym. Degrad. Stab. 2001, 71, 243-251. DOI: https://doi.org/10.1016/S0141-3910(00)00153-1.
Zhou, L.; Zhou, H.; Hou, G.; Ji, F.; Wang, D. J. Appl. Microbiol. 2023, 134, 1–8. DOI: https://doi.org/10.1093/jambio/lxad019.
Chacón, C.; Bojórquez-Quintal, E.; Caamal-Chan, G.; Ruíz-Valdiviezo, V. M.; Montes-Molina, J.A.; Garrido-Ramírez, E.R.; Rojas-Abarca, L.M.; Ruiz-Lau, N. Agronomy. 2021, 11, 1098. DOI: https://doi.org/10.3390/agronomy11061098.
Aboul‐Enein, H. Y.; Kładna, A.; Kruk, I. Luminescence. 2011, 26, 202-207. DOI: https://doi.org/10.1002/bio.1209.
Janssen, A. M.; Scheffer, J. J. C. Planta medica. 1985, 51, 507-511. DOI: https://doi.org/10.1055/s-2007-969577.
Mongkol, R.; Chavasiri, W.; Ishida, M.; Matsuda, K.; Morimoto, M. Weed Biol. Manag. 2015, 15, 87-93. DOI: https://doi.org/10.1111/wbm.12071.
Chopra, D.; Ray, L.; Dwivedi, A.; Tiwari, S. K.; Singh, J.; Singh K. P.; Kushwaha, H. N.; Jahan, S.; Pandey, A.; Gupta, S. K.; Chaturvedi, R. K.; Pant, A. B.; Ray, R. S.; Gupta, K. C. Biomaterials. 2016, 84, 25-41. DOI: https://doi.org/10.1016/j.biomaterials.2016.01.018.
Huang, B. B.; Zhang, S. F.; Chen, P.H.; Wu, G. Sci. Rep. 2017, 7, 10864. DOI: https://doi.org/10.1038/s41598-017-11419-2.

Downloads
Published
Issue
Section
License
Copyright (c) 2024 Felipe Barrera Méndez, Laura Stefany Licona Velázquez, Diter Miranda Sánchez, Aidée Jazmín Anguiano Hernández, Israel Bonilla Landa, José Luis Olivares Romero, Randy Ortíz Castro, Greta Hanako Rosas Saito, Juan Luis Monribot Villanueva, José Antonio Guerrero Analco, Oscar Carmona-Hernández, Juan Carlos Noa Carrazana

This work is licensed under a Creative Commons Attribution-NonCommercial 4.0 International License.
Authors who publish with this journal agree to the following terms:
- Authors retain copyright and grant the journal right of first publication with the work simultaneously licensed under a Creative Commons Attribution License that allows others to share the work with an acknowledgement of the work's authorship and initial publication in this journal.
- Authors are able to enter into separate, additional contractual arrangements for the non-exclusive distribution of the journal's published version of the work (e.g., post it to an institutional repository or publish it in a book), with an acknowledgement of its initial publication in this journal.









