Exploring the Impact of Low Light Intensity on DNA Methylation in Agave angustifolia Haw. Albino Variant
DOI:
https://doi.org/10.29356/jmcs.v67i3.1943Keywords:
Agave, chlorophyll, epigenetic, light, plant cell tissue cultureAbstract
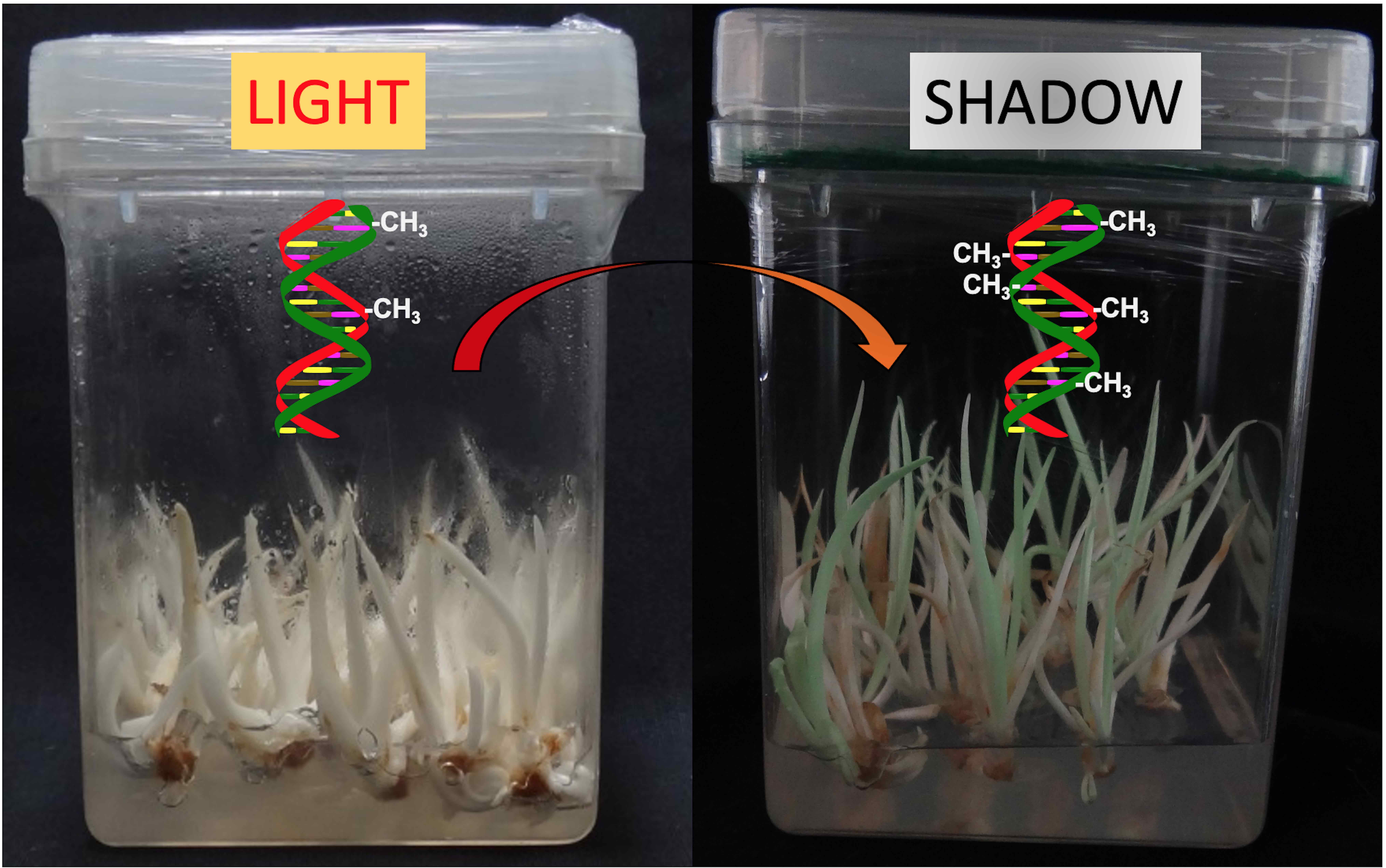
Abstract. Light is an essential environmental factor that regulates important plant processes, including photosynthesis, photoprotection, and the accumulation of pigments such as chlorophylls and carotenoids. Conversely, the absence of light initiates the etiolation phenomenon, characterized by a decrease in photosynthetic and photoprotective pigments. In contrast, albinism is a rare variant characterized by the absence of chloroplasts, chlorophyll, and other pigments, even in the presence of light. Albinism may occur spontaneously in plant tissue culture (PTC) and is considered an unexplored phenotypic variant. During micropropagation of Agave angustifolia Haw., two somaclonal variants emerged from green plantlets: albino and variegated. We demonstrate that low-intensity light exposure triggers greener pigmentation in albino plantlets accompanied by an increase in global DNA methylation levels. Our findings suggest the possibility of chloroplast biogenesis under low-intensity light and provide insight into the potential role of DNA methylation in regulating plant responses to light intensity and highlight the importance of studying the effects of different light conditions on plant development and physiology.
Resumen. La luz es un factor ambiental esencial que regula importantes procesos de las plantas, incluyendo la fotosíntesis, la fotoprotección y la acumulación de pigmentos como las clorofilas y los carotenoides. Por el contrario, la ausencia de luz inicia el fenómeno de etiolación, caracterizado por una disminución de los pigmentos fotosintéticos y fotoprotectores. En contraste, el albinismo es una rara variante caracterizada por la ausencia de cloroplastos, clorofila y otros pigmentos, incluso en presencia de luz. El albinismo puede ocurrir espontáneamente en el cultivo de tejidos vegetales (PTC) y se considera una variante fenotípica inexplorada. Durante la micropropagación de Agave angustifolia Haw. surgieron dos variantes somaclonales a partir de las plántulas verdes: albino y variegado. Demostramos que la exposición a la luz de baja intensidad desencadena una pigmentación verde en las plántulas albinas acompañada de un aumento en los niveles globales de metilación del ADN. Nuestros hallazgos sugieren la posibilidad de la biogénesis de cloroplastos bajo luz de baja intensidad y proporcionan información sobre el posible papel de la metilación del ADN en la regulación de las respuestas de las plantas a la intensidad de la luz, destacando la importancia de estudiar los efectos de diferentes condiciones de luz en el desarrollo y la fisiología de las plantas.
Downloads
References
Karlin-Neumann, G. A.; Sun, L.; Tobin, E. M. Plant Physiol. 1988, 88, 1323-1331. DOI: 10.1104/pp.88.4.1323 DOI: https://doi.org/10.1104/pp.88.4.1323
Gruissem, W. Cell. 1989, 56, 161-170. DOI: https://doi.org/10.1016/0092-8674(89)90889-1.
Batista, D. S., et al. In Vitro Cell. Dev. Biol. Plant. 2018, 54, 195-215. DOI: https://doi.org/10.1007/s11627-018-9902-5.
Nebel, B.; Naylor, A. Am. J. Bot. 1968, 55, 38-44. DOI: https://doi.org/10.1002/j.1537-2197.1968.tb06942.x.
Neumann, K.-H.; Raafat, A. Plant Physiol. 1973, 51, 685-690. DOI: https://doi.org/10.1104/pp.51.4.685.
Kumar, A., et al. Plant Cell Tissue Organ Cult. 1983, 2, 161-177. DOI: https://doi.org/10.1007/BF00043361.
Ma, L., et al. Plant Cell. 2001, 13, 2589-2607. DOI: https://doi.org/10.1105/tpc.010229. DOI: https://doi.org/10.1105/tpc.13.12.2589
Fankhauser, C.; Chory, J. Annu. Rev. Cell Dev. Biol. 1997, 13, 203-229. DOI: https://doi.org/10.1146/annurev.cellbio.13.1.203.
Weis, J.; Jaffe, M. Physiol. Plant. 1969, 22, 171-176. DOI: https://doi.org/10.1111/j.1399-3054.1969.tb07853.x.
Skoog, F. Am. J. Bot. 1944, 19-24 DOI: https://doi.org/10.1002/j.1537-2197.1944.tb07997.x
Seibert, M.; Wetherbee, P. J.; Job, D. D. Plant Physiol. 1975, 56, 130-139. DOI: https://doi.org/10.1104/pp.56.1.130.
Bagga, S., et al. Plant Sci. 1985, 38, 61-64. DOI: https://doi.org/10.1016/0168-9452(85)90080-9.
Ammirato, P.; Steward, F. Bot. Gaz. 1971, 132, 149-158. DOI: https://doi.org/10.1086/336573
Mullet, J. E. Ann. Rev. Plant Physiol. Plant Mol. Biol. 1988, 39, 475-502. DOI: https://doi.org/10.1146/annurev.pp.39.060188.002355
Chory, J., et al. Plant Cell. 1989, 1, 867-880. DOI: https://doi.org/10.1105/tpc.1.9.867.
Brouwer, B.; Gardeström, P.; Keech, O. J. Exp. Bot. 2014, 65, 4037-4049. DOI: https://doi.org/10.1093/jxb/eru060.
Us-Camas, R., et al. Plant Cell Tissue Organ Cult. 2014, 118, 187-201. DOI: https://doi.org/10.1007/s11240-014-0482-8.
Miguel, C.; Marum, L. J. Exp. Bot. 2011, 62, 3713-3725. DOI: https://doi.org/10.1093/jxb/err155.
Duarte-Aké, F.; De-la-Peña, C. Ind. Crops Prod. 2021, 172, 114046. DOI: https://doi.org/10.1016/j.indcrop.2021.114046.
Duarte-Aké, F., et al. Plant Cell Rep. 2016, 35, 2489-2502. DOI: https://doi.org/10.1007/s00299-016-2049-0.
Li, T., et al. Afr. J. Biotechnol. 2011, 10, 6220-6226.
Farrokhzad, Y., et al. Plant Cell Tissue Organ Cult. 2022, 149, 535-548. DOI: https://doi.org/10.1007/s11240-022-02272-x.
Ngernprasirtsiri, J., et al. J. Biol. Chem. 1989, 264, 8241-8248. DOI: https://doi.org/10.1016/S0021-9258(18)83175-1.
Bourbousse, C., et al. Proc. Natl. Acad. Sci. 2015, 112, E2836-E2844. DOI: https://doi.org/10.1073/pnas.150351211.
Duarte-Aké, F., et al. Environ. Exp. Bot. 2019, 159, 108-120. DOI: https://doi.org/10.1016/j.envexpbot.2018.12.010.
Langdale, J. A.; Taylor, W. C.; Nelson, T. Mol. Gen. Genet. 1991, 225, 49-55. DOI: https://doi.org/10.1007/BF00282641.
Wellburn, A. R. J. Plant Physiol. 1994, 144, 307-313. DOI: https://doi.org/10.1016/S0176-1617(11)81192-2.
Echevarría-Machado, I., et al. Mol. Biotechnol. 2005, 31, 129-135. DOI: https://doi.org/10.1385/MB:31:2:129.
De-la-Peña, C., et al. BMC Plant Biol. 2012, 12, 1-11. DOI: doi:10.1186/1471-2229-12-203 DOI: https://doi.org/10.1186/1471-2229-12-203
Aluru, M. R., et al. Plant Physiol. 2001, 127, 67-77. DOI: https://doi.org/10.1104/pp.127.1.67.
Guo, Y.-D.; Sewón, P.; Pulli, S. Plant Cell Tissue Organ Cult. 1999, 57, 85-93. DOI: https://doi.org/10.1023/A:1006392411276.
Matile, P.; Hörtensteiner, S.; Thomas, H. Ann. Rev. Plant Biol. 1999, 50, 67-95. DOI: https://doi.org/10.1146/annurev.arplant.50.1.67.
Li, W., et al. PLoS Genet. 2011, 7, e1002243. DOI: https://doi.org/10.1371/journal.pgen.1002243.
Cancino-García, V. J.; Ramírez-Prado, J. H.; De-la-Peña, C. Sci. Rep. 2020, 10, 1-11. DOI: https://doi.org/10.1038/s41598-020-60865-y.

Downloads
Published
Issue
Section
License
Copyright (c) 2023 Fátima Duarte-Aké, Clelia De-la-Peña

This work is licensed under a Creative Commons Attribution-NonCommercial 4.0 International License.
Authors who publish with this journal agree to the following terms:
- Authors retain copyright and grant the journal right of first publication with the work simultaneously licensed under a Creative Commons Attribution License that allows others to share the work with an acknowledgement of the work's authorship and initial publication in this journal.
- Authors are able to enter into separate, additional contractual arrangements for the non-exclusive distribution of the journal's published version of the work (e.g., post it to an institutional repository or publish it in a book), with an acknowledgement of its initial publication in this journal.









