Unveiling [3 + 2] Cycloaddition Reactions of N-Methyl-C-3-Bromophenyl-Nitrone to Dimethyl Maleate: Molecular Electron Density Theory Perspective
DOI:
https://doi.org/10.29356/jmcs.v66i4.1801Keywords:
Molecular electron density theory, nitrone, ¨[3 2] cycloaddition reactions, electron localization functionAbstract
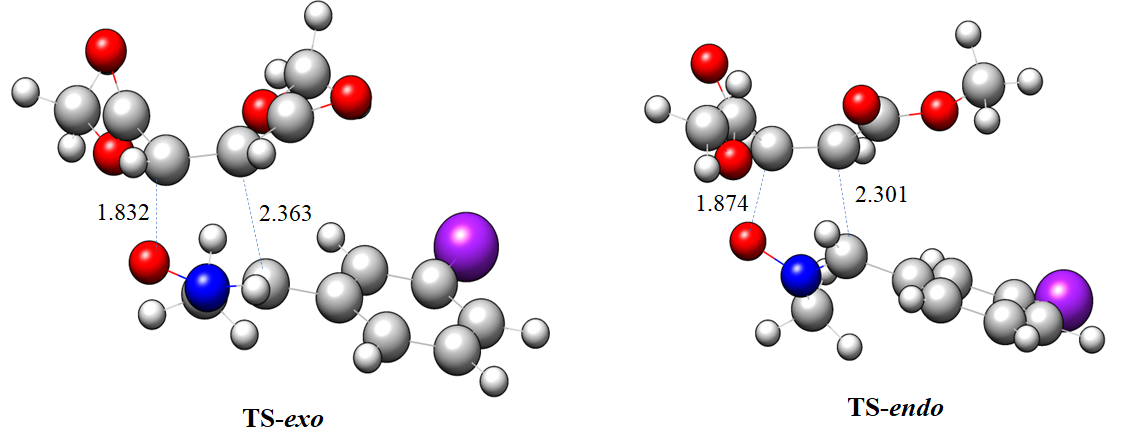
Abstract. The zwitterionic-type (zw-type) [3+2] cycloaddition (32CA) reactions of N-methyl-C-3-bromophenyl-nitrone 1 with dimethyl maleate 2 with increased electrophilicity were investigated using the Molecular Electron Density Theory (MEDT) at the MPWB95/6-311++G(d,p) computational level. Both reactivity and selectivity are rationalized in relation to the polarity of the reaction. The associated zw-type 32CA reactions are accelerated due to the high nucleophilic character of N-methyl-C-3-bromophenyl-nitrone 1 and the strong electrophilic character of dimethyl maleate 2, which also play a critical part in the mechanism of the reaction, influencing the stereoselectivity, with activation enthalpies in between 34.04 and 38.37 kJ.mol-1 in the gas phase. The CDFT indices are used to anticipate global electron density flux from the nucleophilic N-methyl-C-3-bromophenyl-nitrone 1 to the electrophilic dimethyl maleate 2. These exergonic 32CA reactions have negative Gibbs free energy along the endo and exo stereochemical pathways. The endo stereochemical process is preferred over the exo stereochemical pathway in this kinetically controlled 32CA reaction. The predictions of bonding evolution theory (BET) for the endo and exo pathways indicate a one-step process with early transition states, which is compatible with the ELF topological examination of transition states.
Resumen. Las reacciones de cicloadición de tipo zwitteriónico (tipo zw) [3+2] (32CA) de N-metil-C-3-bromofenil-nitrona 1 con maleato de dimetilo 2 con aumento de la electrofilicidad se investigaron utilizando la Teoría de la Densidad Electrónica Molecular (MEDT, por sus siglas en inglés) utilizando el nivel de teoría MPWB95/6-311++G(d,p). Tanto la reactividad como la selectividad se racionalizan en relación con la polaridad de la reacción. Las reacciones asociadas de tipo zw 32CA se aceleran debido al alto carácter nucleofílico de N-metil-C-3-bromofenil-nitrona 1 y al fuerte carácter electrofílico del maleato de dimetilo 2, que también juega un papel crítico en el mecanismo de la reacción, influyendo en la estereoselectividad, con entalpías de activación entre 34.04 y 38.37 kJ.mol-1, en fase gaseosa. Los índices de la Teoría de Funcionales de la Densidad Conceptual (CDFT, por sus siglas en inglés) se utilizan para anticipar el flujo global de densidad de electrones desde el nucleófilo N-metil-C-3-bromofenil-nitrona 1 hasta el maleato de dimetilo electrofílico 2. Estas reacciones exergónicas 32CA tienen energías libres de Gibbs negativa a lo largo de las vías estereoquímicas endo y exo. El proceso estereoquímico endo es preferido sobre la vía estereoquímica exo en esta reacción 32CA controlada cinéticamente. Las predicciones de la teoría de la evolución de enlaces (BET, por sus siglas en inglés) para las vías endo y exo indican un proceso de un paso con estados de transición temprana, que es compatible con el examen topológico de la Función de Localización Electrónica (ELF, por sus siglas en inglés) de los estados de transición.
Downloads
References
Ríos‐Gutiérrez, M.; Domingo, L. R. Eur. J. Org. Chem. 2019, 2019, 267-282. DOI: https://doi.org/10.1002/ejoc.201800916
Huisgen, R. Angew. Chem., Int. Ed. Engl. 1963, 2, 565-598. DOI: https://doi.org/10.1002/anie.196305651
Padwa, A.; Pearson, W. H. Vol. 59, Ed., John Wiley & Sons, 2003.
Mótyán, G.; Kádár, Z.; Kovács, D.; Wölfling, J.; Frank, É. Steroids. 2014, 87, 76-85. DOI: 10.1016/j.steroids.2014.05.019
Jakowiecki, J.; Loska, R.; Makosza, M. J. Org. Chem. 2008, 73, 5436-5441. DOI: https://doi.org/10.1021/jo800721w
Seerden, J.-P. G.; Boeren, M. M.; Scheeren, H. W. Tetrahedron 1997, 53, 11843-11852. DOI: https://doi.org/10.1016/S0040-4020(97)00757-6
Andrés, J.; Gracia, L.; González-Navarrete, P.; Safont, V. S. Comput. Theor. Chem. 2015, 1053, 17-30. DOI:10.1016/j.comptc.2014.10.010
Domingo, L. R. Molecules. 2016, 21, 1319. DOI: 10.3390/molecules21101319
Domingo, L. R.; Ríos-Gutiérrez, M.; Pérez, P. J. Org. Chem. 2018, 83, 2182-2197. DOI: 10.1021/acs.joc.7b03093.
Domingo, L. R.; Kula, K.; Ríos‐Gutiérrez, M. Eur. J. Org. Chem. 2020, 2020, 5938-5948. DOI: https://doi.org/10.1002/ejoc.202000745
Woodward, R. B.; Hoffmann, R. Angew. Chem., Int. Ed. Engl. 1969, 8, 781-853. DOI: https://doi.org/10.1002/anie.196907811
Houk, K. N. Accounts of Chemical Research 1975, 8, 361-369. DOI: https://doi.org/10.1021/ar50095a001
Houk, K. N.; Gonzalez, J.; Li, Y. Acc. Chem. Res. 1995, 28, 81-90. DOI: https://doi.org/10.1021/ar00050a004
Arrieta, A.; María, C.; de Cozar, A.; Sierra, M. A.; Cossio, F. P. Synlett. 2013, 24, 535-549. DOI: 10.1055/s-0032-1318217
Domingo, L. R.; Ríos-Gutiérrez, M. Molecules. 2017, 22, 750. DOI: 10.3390/molecules22050750
Lednicer, D.; Mitscher, L. A., Vol. 1, Ed., John Wiley & Sons: 1980.
Artemov, A.; Sazonova, E.; Zarovkina, N. Y. Russ. Chem. Bull. 2013, 62, 1382-1387. DOI: https://doi.org/10.1007/s11172-013-0197-8
Mohammad-Salim, H. A. J. Mex. Chem. Soc. 2021, 65, 129-140. DOI:10.29356/jmcs.v65i1.1437.
Mohammad-Salim, H.; Hassan, R.; Abdallah, H. H.; Oftadeh, M. J. Mex. Chem. Soc. 2020, 64, 147-164. DOI: https://doi.org/10.29356/jmcs.v64i2.1111
Acharjee, N.; Mohammad-Salim, H. A.; Chakraborty, M. Theor. Chem. Acc. 2021, 140, 1-15. DOI: https://doi.org/10.1007/s00214-021-02811-3
Mohammad‐Salim, H. A.; Acharjee, N.; Domingo, L. R.; Abdallah, H. H. Inter. Quantum Chem. 2021, 121, e26503. DOI: https://doi.org/10.1002/qua.26503
Mohammad-Salim, H. A. Theor. Chem. Acc. 2021, 140, 1-9. DOI: https://doi.org/10.1007/s00214-021-02789-y
Krylov, A.; Windus, T. L.; Barnes, T.; Marin-Rimoldi, E.; Nash, J. A.; Pritchard, B.; Smith, D. G.; Altarawy, D.; Saxe, P.; Clementi, C. J. Chem. Phys. 2018, 149, 180901. DOI: https://doi.org/10.1063/1.5052551
Acharjee, N.; Mohammad-Salim, H. A.; Chakraborty, M. Struct. Chem. 2022, 1-16. DOI: https://doi.org/10.21203/rs.3.rs-1122676/v1.
Ríos-Gutiérrez, M.; Darù, A.; Tejero, T.; Domingo, L. R.; Merino, P. Org. Biomol. Chem. 2017, 15, 1618-1627. DOI: https://doi.org/10.1039/C6OB02768G.
Domingo, L. R.; Ríos-Gutiérrez, M.; Pérez, P. Org. Biomol. Chem. 2019, 17, 498-508. DOI: https://doi.org/10.1039/C8OB02568A.
Domingo, L. R.; Acharjee, N. New J. Chem. 2020, 44, 13633-13643. DOI: https://doi.org/10.1039/D0NJ02711A
Wiberg, K. B.; Hehre, W. J.; Radom, L. P.; Schleyer, R.; Pople, J. A. in: Ab Initio Molecular Orbital Theory, Ed., John Wiley, New York, 1986, 548.
Schlegel, H. B. J. Comput. Chem. 1982, 3, 214-218. DOI: https://doi.org/10.1002/jcc.540030212.
Dresler, E.; Kącka-Zych, A.; Kwiatkowska, M.; Jasiński, R. J. Mol. Model. 2018, 24, 1-12. DOI: https://doi.org/10.1007/s00894-018-3861-y.
Alnajjar, R. A.; Jasiński, R. J. Mol. Model. 2019, 25, 1-9. DOI: https://doi.org/10.1007/s00894-019-4006-7.
Adjieufack, A.; Ndassa, I. M.; Mbadcam, J. K.; Ríos-Gutiérrez, M.; Domingo, L. Theor. Chem. Acc. 2017, 136, 1-12. DOI:10.1007/s00214-016-2028-0.
Acharjee, N.; Mohammad‐Salim, H. A.; Chakraborty, M.; Rao, M. P.; Ganesh, M. J. Phys. Org.Chem. 2021, 34, e4189. DOI: https://doi.org/10.1002/poc.4189.
Acharjee, N.; Mohammad-Salim, H. A.; Chakraborty, M. J. Serb. Chem. Soc. 2021, 106-106. DOI: https://doi.org/10.2298/JSC211014106A.
Fukui, K. J. Phys. Chem. 1970, 74, 4161-4163. DOI: https://doi.org/10.1021/j100717a029.
Gonzalez, C.; Schlegel, H. B. J. Phys. Chem. 1990, 94, 5523-5527. DOI: https://doi.org/10.1021/j100377a021.
Gonzalez, C.; Schlegel, H. B. J. Chem. Phys. 1991, 95, 5853-5860. DOI: https://doi.org/10.1063/1.461606.
Tomasi, J.; Persico, M. Chem. Rev. 1994, 94, 2027-2094. DOI: https://doi.org/10.1021/cr00031a013.
Simkin, B. I. A. k.; Sheĭkhet, I. I. i., Ellis Horwood: 1995.
Cossi, M.; Barone, V.; Cammi, R.; Tomasi, J. Chem. Phys. Lett. 1996, 255, 327-335. DOI: https://doi.org/10.1016/0009-2614(96)00349-1.
Cances, E.; Mennucci, B.; Tomasi, J. J. Chem. Phys. 1997, 107, 3032-3041. DOI: https://doi.org/10.1063/1.474659.
Barone, V.; Cossi, M.; Tomasi, J. J. Comput. Chem. 1998, 19, 404-417. DOI: https://doi.org/10.1002/(SICI)1096-987X(199803)19:4<404::AID-JCC3>3.0.CO;2-W.
Geerlings, P.; De Proft, F.; Langenaeker, W. Chem. Rev. 2003, 103, 1793-1874. DOI: https://doi.org/10.1021/cr990029p.
Domingo, L. R.; Ríos-Gutiérrez, M.; Pérez, P. Molecules. 2016, 21, 748. DOI: https://doi.org/10.3390/molecules21060748.
Domingo, L. R., RSC Adv. 2014, 4, 32415-32428. DOI: https://doi.org/10.1039/C4RA04280H.
Reed, A. E.; Weinstock, R. B.; Weinhold, F. J. Chem. Phys. 1985, 83, 735-746. DOI: https://doi.org/10.1063/1.449486.
Reed, A. E.; Curtiss, L. A.; Weinhold, F. Chem. Rev. 1988, 88, 899-926. DOI: https://doi.org/10.1021/cr00088a005.
Becke, A. D.; Edgecombe, K. E. J. Chem. Phys. 1990, 92, 5397-5403. DOI: 10.1063/1.458517.
Silvi, B.; Savin, A. Nature. 1994, 371, 683-686. DOI: 10.1038/371683a0.
Rıos-Gutiérrez, M.; Domingo, L. J. Org. Chem. 2019, 267. DOI: https://doi.org/10.1002/ejoc.201800916.
Huisgen, R. J. Org. Chem. 1976, 41, 403-419. DOI: https://doi.org/10.1021/jo00865a001.
Parr, R. G., Oxford University Press 1989, 1, 1989. DOI: https://doi.org/10.1002/qua.560470107.
Parr, R. G.; Yang, W. Annu. Rev. Phys. Chem. 1995, 46, 701-728. DOI: https://doi.org/10.1146/annurev.pc.46.100195.003413.
Domingo, L. R.; Ríos-Gutiérrez, M.; Pérez, P. RSC Adv. 2020, 10, 15394-15405. DOI: https://doi.org/10.1039/D0RA01548B.
Thom, R., Paris (tr. it. Stabilità strutturale e morfogenesi, Einaudi 1980) 1972.
Krokidis, X.; Noury, S.; Silvi, B. J. Phys. Chem. A. 1997, 101, 7277-7282. DOI:10.1021/JP9711508.
Deng, L.; Ziegler, T. Inter. J. Quantum Chem. 1994, 52, 731-765. DOI: https://doi.org/10.1002/qua.560520406.
Domingo, L. R.; Saéz, J. A.; Zaragozá, R. J.; Arnó, M. J. Org. Chem. 2008, 73, 8791-8799. DOI: 10.1021/jo801575g.
Downloads
Published
Issue
Section
License
Copyright (c) 2022 Sabir A. Mohammed Salih, Huda A. Basheer, Haydar A. Mohammad-Salim

This work is licensed under a Creative Commons Attribution-NonCommercial 4.0 International License.
Authors who publish with this journal agree to the following terms:
- Authors retain copyright and grant the journal right of first publication with the work simultaneously licensed under a Creative Commons Attribution License that allows others to share the work with an acknowledgement of the work's authorship and initial publication in this journal.
- Authors are able to enter into separate, additional contractual arrangements for the non-exclusive distribution of the journal's published version of the work (e.g., post it to an institutional repository or publish it in a book), with an acknowledgement of its initial publication in this journal.









