System Suitability Testing of the Method Developed to Measure the Active Concentration of a Fab Fragment Via Surface Plasmon Resonance
System Suitability Testing of Fab Fragment Concentration Measurement via Surface Plasmon Resonance
DOI:
https://doi.org/10.29356/jmcs.v65i4.1527Keywords:
Fab fragment, concentration measurement, surface plasmon resonance, biopharmaceutics, system suitability testingAbstract
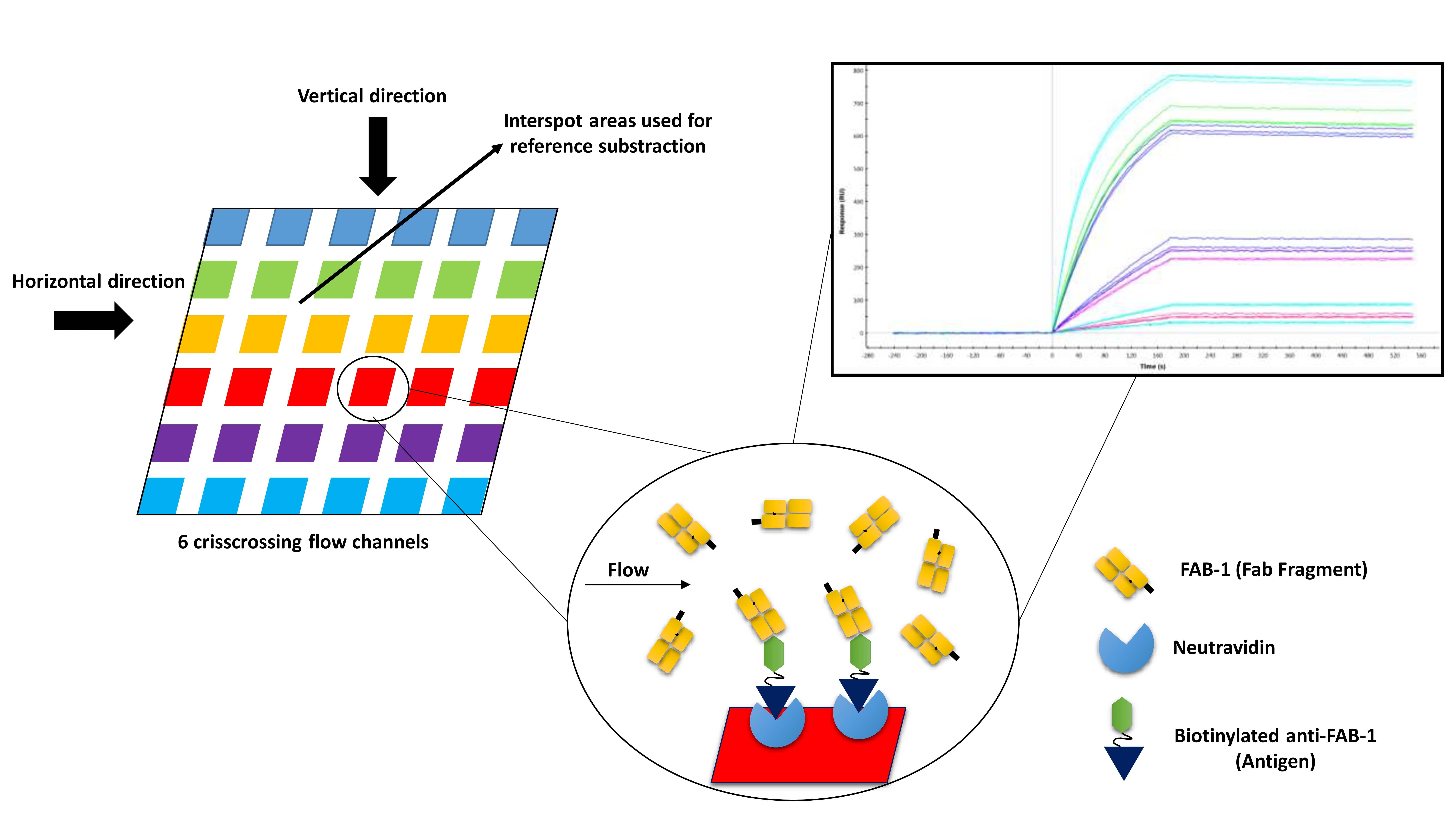
Abstract. SPR methods are increasingly accepted by the biopharmaceutical industry in quality control (QC), R&D and clinical research. However, there are few reports on method validation and system suitability testing (SST), in particular on concentration determination methods related to the potency of the drug. System compliance must be demonstrated with certain tests in order, for the method validation to be ensured, as agreed by the scientific community and the industry, and specified in the guidelines. To contribute to the alleviation of the deficiency in this matter, we developed a system suitability testing of an SPR-based active concentration measurement method using Fab-fragment as a model. High amounts of anti-FAB1 were captured onto sensor chip surfaces via biotin/neutravidin interaction. The unknown concentration of FAB1 measured via calibration curve dependent concentration measurement. Controls were run between unknown samples to check the reliability of the method. The standard four-parameter logistic equation was used to determine the unknown concentration. CV % of samples and Difference % of controls form standards were calculated from obtained data. The CV % and Diff. % values were less than or equal to 10 % at each parameter. The 100 % level of unknown sample measured as 105 %. Obtained CV % values and repeated analyses showed that the system and method are suitable for the concentration analysis of the FAB1 fragment. The system suitability parameters evaluated in the study can be applied for all SPR analyzes.
Resumen. Los métodos SPR (Surface Plamon Resonance) son cada vez más aceptados por la industria biofarmacéutica en el control de calidad (QC), investigación y desarrollo (R & D) e investigación clínica. Sin embargo, existen pocos informes sobre la validación de los métodos y las pruebas de idoneidad del sistema (SST), en particular sobre los métodos de determinación de la concentración relacionados con la potencia del fármaco. La idoneidad del sistema debe demostrarse para garantizar la validación del método, según la normatividad acordada por la comunidad científica y la industria. Con el fin de contribuir al alivio de la deficiencia en este asunto, se desarrolló una prueba de idoneidad del sistema con un método de medición de concentración activa basado en SPR utilizando el fragmento Fab como modelo. Se capturaron grandes cantidades de anti-FAB1 en las superficies del chip sensor mediante la interacción biotina/neutravidina. Se estableció la concentración desconocida de FAB1 a través de la determinación de la concentración dependiente de la curva de calibración. Se ejecutaron controles entre muestras desconocidas para comprobar la fiabilidad del método. Se utilizó una ecuación estándar de cuatro parámetros para determinar la concentración desconocida. A partir de los datos obtenidos se determinó el porcentaje de CV de las muestras y la diferencia respecto a los controles. Los valores de % CV y % Diff. fueron menores o iguales al 10 % en cada parámetro. Los valores de % CV obtenidos y los análisis repetidos mostraron que el sistema y el método son adecuados para el análisis de concentración del fragmento FAB1. Los parámetros de idoneidad del sistema evaluados en el estudio se pueden aplicar a todos los análisis SPR.
Downloads
References
Olaru, A.; Bala, C.; Jaffrezic-Renault, N.; Aboul-Enein, H. Y. Crit. Rev. Anal. Chem. 2015, 45, 97-105.
Masson, J.-F. ACS Sens. 2017, 2, 16-30.
Wadhwa, M.; Thorpe, R. Bioanalysis. 2019, 11, 1593-1604.
Alt, N.; Zhang, T. Y.; Motchnik, P.; Taticek, R.; Quarmby, V.; Schlothauer, T.; Beck, H.; Emrich, T.; Harris, R. J. Biologicals 2016, 44, 291-305.
Le Basle, Y.; Chennell, P.; Tokhadze, N.; Astier, A.; Sautou, V. J. Pharm. Sc. 2020, 109, 169-190.
Rathore, N.; Rajan, R. S. Biotechnol. Prog. 2008, 24, 504-14.
Yang, D.; Singh, A.; Wu, H.; Kroe-Barrett, R. Anal. Biochem. 2016, 508, 78-96.
Yang, D.; Frego, L.; Lasaro, M.; Truncali, K.; Kroe-Barrett, R.; Singh, S. J. Biol. Chem. 2016, 291, 16361-74.
Pope, M. E.; Soste, M. V.; Eyford, B. A.; Anderson, N. L.; Pearson, T. W. J. Immunol. Methods. 2009, 341, 86-96.
Myszka, D. G. J. Mol. Recognit. 1999, 12, 279-84.
Rich, R. L.; Myszka, D. G. J. Mol. Recognit. 2008, 21, 355-400.
Group, I. E. W., Validation Of Analytical Procedures: Text And Methodology Q2(R1). Use, I. C. O. H. O. T. R. F. R. O. P. F. H., Ed. 1994.
Welch, N. G.; Scoble, J. A.; Muir, B. W.; Pigram, P. J. Biointerphases. 2017, 12, 02D301.
Kikuchi, Y.; Uno, S.; Nanami, M.; Yoshimura, Y.; Iida, S.-i.; Fukushima, N.; Tsuchiya, M. J. Biosci. Bioeng. 2005, 100, 311-317.
Thillaivinayagalingam, P.; Newcombe, A. R.; O'Donovan, K.; Francis, R.; Keshavarz-Moore, E. Biotechnol. Appl. Biochem. 2007, 48, 179-88.
Hutsell, S. Q.; Kimple, R. J.; Siderovski, D. P.; Willard, F. S.; Kimple, A. J. Methods Mol. Biol. 2010, 627, 75-90.

Downloads
Published
Issue
Section
License
Authors who publish with this journal agree to the following terms:
- Authors retain copyright and grant the journal right of first publication with the work simultaneously licensed under a Creative Commons Attribution License that allows others to share the work with an acknowledgement of the work's authorship and initial publication in this journal.
- Authors are able to enter into separate, additional contractual arrangements for the non-exclusive distribution of the journal's published version of the work (e.g., post it to an institutional repository or publish it in a book), with an acknowledgement of its initial publication in this journal.









